精彩内容
2018年1月8日,恒瑞医药与美国TG Therapeutics公司达成许可协议,恒瑞将具有自主知识产权的BTK抑制剂SHR1459和SHR1266(美国代号分别为TG-1701和TG-1702)有偿许可给美国TG公司。这是继1月4日后,恒瑞医药今年第二个与外国企业之间的有偿许可项目。恒瑞医药自2000年上市以来,已与三家美国公司达成了许可协议,究竟是哪些重磅产品走出了国门呢?这些年来,在国外上市销售的制剂又有哪些呢?
四大在研新品走向世界
表1:恒瑞医药与三家美国公司达成许可协议的详细情况
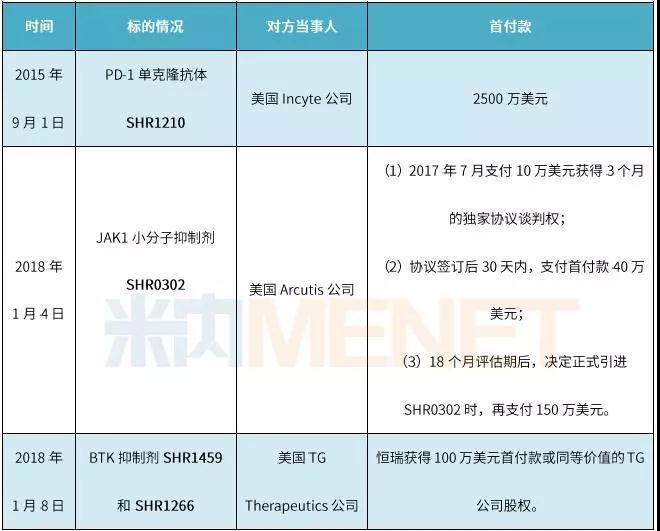
(资料来源:上市公司公告)
PD-1单克隆抗体SHR1210
2015年9月1日,恒瑞与美国Incyte公司在美国达成协议,恒瑞将具有自主知识产权的用于肿瘤免疫治疗的PD-1单克隆抗体(代号SHR1210)项目有偿许可给美国Incyte公司,Incyte公司获得除中国大陆、香港、澳门和台湾地区以外的全球临床开发和市场销售的权利。
协议约定,美国Incyte公司向恒瑞支付首付款2500万美元。上市里程碑付款方面,SHR1210在欧盟、美国、日本成功上市后,美国Incyte公司向恒瑞支付累计不超过9000万美元的里程碑款。临床优效里程碑付款方面,SHR1210在国外临床试验结果取得优效,美国Incyte公司向恒瑞支付1.5亿美元。销售业绩里程碑付款方面,SHR1210年销售额达到不同的目标后,美国Incyte公司向恒瑞支付累计不超过5.3亿美元的里程碑款。销售提成方面,SHR1210在国外上市后,恒瑞按照约定比例从其年销售额中提成。
据2015年年报数据显示,恒瑞医药已收到协议首付款加里程碑款总额达到7.95亿美元。
恒瑞医药2012年开始从事PD-1单克隆抗体的研发工作,目前公司已申请了SHR1210的国内专利和PCT国际专利,该产品已获CFDA批准新药临床。美国Incyte公司承诺在协议签订后开展临床试验。
JAK1小分子抑制剂SHR0302
2018年1月4日,恒瑞与美国Arcutis公司在美国达成协议,恒瑞将具有自主知识产权的用于治疗免疫系统疾病的JAK1抑制剂(代号SHR0302)项目有偿许可给美国Arcutis公司。Arcutis公司获得在美国、欧盟和日本的临床开发、注册和市场销售的权利,被许可进行研发和销售的SHR0302剂型范围为用于皮肤疾病治疗的局部外用制剂。
协议约定,美国Arcutis公司在2017年7月支付给恒瑞10万美元以获得3个月的协议谈判权。协议签订后30天内,美国Arcutis公司将向恒瑞支付首付款40万美元。从协议签订日起,美国Arcutis公司将获得18个月的评估期,进行外用制剂的研发和多至临床IIa期的药效概念验证试验。当美国Arcutis公司决定正式引进SHR0302时,Arcutis公司需再向恒瑞支付 150 万美元。
开发和上市里程碑付款方面,当SHR0302进入美国Arcutis公司的III期临床试验时,恒瑞可获得300万美元。SHR0302在美国、欧盟和日本成功上市后,美国Arcutis公司向恒瑞支付累计不超过1,750万美元的里程碑款。销售业绩里程碑付款方面,SHR0302的销售额达到2.5亿至10亿美元以上的区间,美国Arcutis公司将向恒瑞支付累计不超过2亿美元的里程碑款,每个目标的金额范围为2,000万美元至1亿美元。销售提成方面,SHR0302在美国、欧盟和日本上市后,恒瑞按照约定比例从其销售额中获取提成,提成比例范围为6%至12%。
目前,恒瑞已在中国健康受试者中完成了Ⅰ期临床试验,正在Ⅱ期临床试验中继续开发SHR0302通过口服给药治疗自身免疫疾病。美国Arcutis公司将在协议签订后准备开展相关试验。据悉,恒瑞多可获得共2.23亿美元的首付款和里程碑款,外加销售提成。
BTK抑制剂SHR1459和SHR1266
2018年1月8日,恒瑞与美国TGTherapeutics公司达成许可协议,恒瑞将具有自主知识产权的BTK抑制剂SHR1459和SHR1266(美国代号分别为TG-1701和TG-1702)有偿许可给美国TG公司。TG公司将获得其在亚洲以外的区域(但包括日本)单用或联合药物治疗恶性血液肿瘤的临床开发和市场销售的权利。
协议约定,协议签订后90天内,恒瑞可获得100万美元的首付款或同等价值的TG公司股权。
开发和获批里程碑付款方面,当每个BTK抑制剂进入临床试验不同的阶段后,恒瑞可获得累计不超过710万美元的里程碑款或同等价值的TG公司股权。当每个BTK抑制剂和其它治疗血液肿瘤的药物联用时,或通过海外临床试验证实比伊布替尼或阿卡拉布替尼BTK抑制剂更加优越时,恒瑞可获得约3,800万美元的里程碑款或同等价值的TG公司股权。每个BTK抑制剂在许可范围国家获批后,TG公司向恒瑞支付累计不超过4,800万美元的里程碑款。销售业绩里程碑付款方面,每个BTK抑制剂的销售额达到2.5亿至10亿美元以上的区间,TG公司向恒瑞支付累计不超过8,000万美元的里程碑款,每个目标的金额范围为1,000万美元至5,000万美元。
销售提成方面,每个BTK抑制剂在国外上市后,恒瑞按照约定比例从其销售额中获取提成,提成比例范围为10%至12%。
2017年12月,恒瑞启动SHR1459中国Ⅰ期临床试验,用于治疗血液肿瘤。SHR1266目前处于临床前研发阶段。TG公司将在协议签订后准备开展试验,双方通力合作,全力推动该项目的开发和上市工作。据悉,恒瑞可获得约3.47亿美元的首付款和里程碑款,外加销售提成。
12个制剂已获批在国外上市销售
表2:恒瑞医药获批在国外上市销售的制剂情况
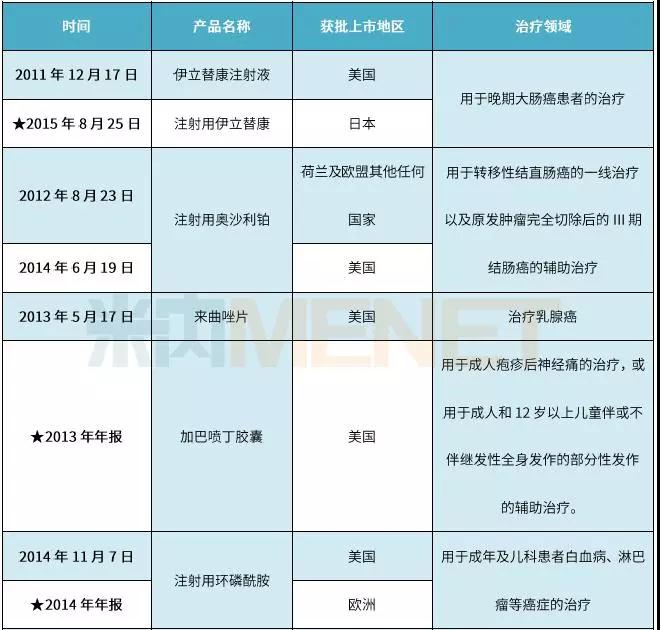
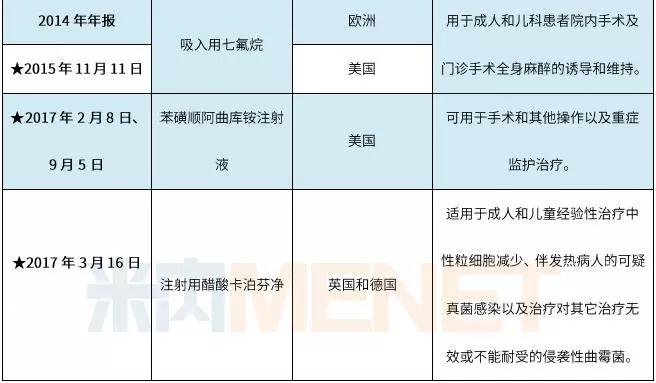
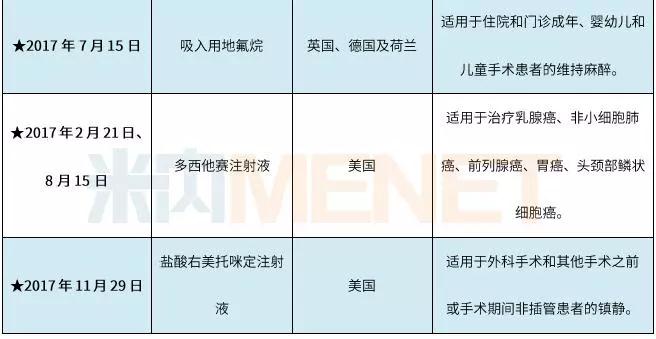
(资料来源:上市公司公告整理,★为公告日期)
恒瑞医药自2000年上市以来,在制剂产品国际化方面不断取得优异的成绩。据上市公司公告及年报资料统计,恒瑞医药自2011年伊立替康注射液成功获批在美国上市销售后,对海外市场的信心日益增强,到目前为止约有12个制剂成功获批在多个国家上市销售。
据年报数据显示,恒瑞医药2016年国外地区的营业收入超过了4.3亿元,增长率为21.47%,毛利率达91.41%,制剂产品国际化对于公司业绩的拉动作用不断增大。
2017年是恒瑞医药制剂产品国际化的丰收年,苯磺顺阿曲库铵注射液、多西他赛注射液、盐酸右美托咪定注射液三大产品的ANDA获得批准在美国上市,注射用醋酸卡泊芬净获得英国药品和健康产品管理局以及德国联邦药物与医疗器械所批准在英国和德国上市,吸入用地氟烷获得英国、德国及荷兰药监局签发的书面通知批准上市。上述制剂陆续在获批地区上市销售后,将为公司带来更加理想的业绩回报。
结语有研报认为,恒瑞医药研发实力强劲,并且在研产品线丰富,未来三年将步入“创新药+制剂出口”收获期,从目前数据来看,2017年正是这个收获期的起点。该公司国际化的战略不再只是制剂“走出去”,2018开年就有两个在研产品成功完成权利许可,也给公司带来新的思路与发展方向。随着公司在海外市场布局的逐步完善与拓展,恒瑞未来有望成长为国际化的制药企业。
注:上述统计范围为2000年至2018年1月12日的上市公司年报、公告。如有错漏,敬请指正。